
Jusqu’aux travaux de Bohr, on ne comprend pas pourquoi chaque élément a sa propre signature spectrale. Lorsqu’Einstein apprend ce que Bohr vient de réaliser, il dit : « c’est l’une des plus grandes découvertes ».
Résumé
En septembre 1912, un jeune étudiant danois, Niels Bohr se penche sur le problème de stabilité de l’atome de Rutherford. Il voit dans ce modèle une limite de la physique classique. Il décide de voir si le quantum découvert par Planck et utilisé efficacement par Einstein, hypothèse qui sort de la physique classique, peut avoir un rôle.
Convaincu que les électrons ont des états stationnaires, puisque les atomes sont stables, il impose aux électrons une orbite particulière à l’intérieur de l’atome. En janvier 1913, l’anglais John Nicholson soutient qu’un anneau d’électron ne peut être stable que si le moment angulaire a une valeur qui est un multiple entier d’une certaine quantité. Bohr s’empresse d’introduire la quantification du moment cinétique dans son modèle de l’atome avec des états stationnaires.
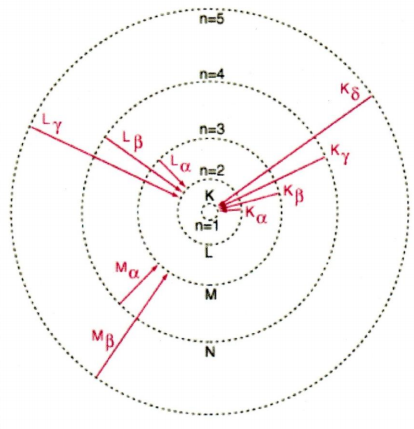
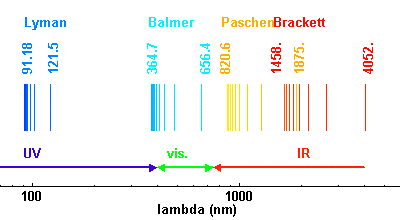
Le pas décisif est suggéré en février 1913 par un autre jeune danois, Hans Hansen (1886-1956), qui demande à Bohr si ses travaux peuvent expliquer les différentes séries dans le spectre de l’hydrogène et s’il existe un lien avec la formule de Balmer. Bohr, qui ne connait pas la loi empirique de Balmer, comprend rapidement que les raies observées sur les spectres correspondent à des sauts quantiques entre deux niveaux d’énergie.









Références bibliographiques et webographiques
Franck, James & Hertz Gustav, Über Zusammenstöße zwischen Elektronen und den Molekülen des Quecksilberdampfes und die Ionisierungsspannung desselben. Verh. Deutsche Phys. Ges. 16, 457-467, 1914. https://doi.org/10.1002/phbl.19670230702
Kumar Manjit, Le grand roman de la physique quantique, Flammarion, Libres Champs, 2020.
L’image en avant a été généré par l’intelligence artificielle.
Toutes les autres images sont issues de Wikipedia.
Référence musicale
Jordan Irvin Daly – Shanidar (Camaraderie Limited, 2009)

Laisser un commentaire