
Une amie a attiré mon attention sur une pile qui fonctionne depuis plusieurs décennies et qui est à Bucarest : la pile Karpen. Quelle est cette pile qui semble s’affranchir des lois de la physique ? Enquête.
Vasilesco Karpen
Originaire de Craiova, dans le sud de la Roumanie, Vasilesco fait ses études supérieures à Bucarest où il devient ingénieur, puis après quelques années, il part faire une thèse de physique à Paris où il reçoit son doctorat en 1904 à 34 ans. Il retourne en Roumanie où il enseigne à l’Ecole des ponts, des routes et des mines dont il devient le directeur en 1920. Il est élu membre de l’Académie roumaine et il poursuit des recherches en électrochimie. Il communique ses travaux à l’Académie des Sciences française, d’où nous pouvons retracer les origines de sa pile miraculeuse…
Description de la pile
Une recherche rapide amène sur le site de l’Académie des Records du Monde et je vous invite à y aller pour voir la tête de la pile. On y lit :
« La pile de Karpen, également connue sous le nom de « pile K » ou « pile thermoélectrique à température uniforme », est une pile électrique inventée par l’inventeur roumain Nicolae Vasilescu-Karpen. Brevetée en 1924 et fabriquée en 1950, elle est toujours en fonctionnement et exposée au Musée technique national « Prof. ing. Dimitrie Leonida » de Bucarest. Elle produit toujours une énergie électrique mesurable, établissant le record du monde de la batterie à cellule humide la plus durable, selon l’Académie des records du monde.
La pile de Karpen est composée d’une électrode en or et d’une électrode en platine, tandis que l’électrolyte est de l’acide sulfurique de haute pureté.
Les potentiels des deux électrodes (+1,52 V pour l’or et +1,188 V pour le platine) permettent de déterminer que ce fil électrochimique peut générer une tension d’environ 0,33 V. Deux cellules découpées fourniront près de 0,7 V.
Le prototype de pile de Karpen, assemblé en 1950, est constitué de deux piles électriques connectées en série actionnant un petit moteur galvanométrique. Ce moteur actionne une lame connectée à un interrupteur. À chaque demi-rotation, la lame ouvre le circuit et le ferme au début de la seconde. Le temps de rotation de la lame a été calculé de manière à ce que les piles aient le temps de se recharger et de rétablir leur polarité pendant la durée d’ouverture du circuit. »
Les publications
On sait depuis 1800 et les travaux d’Alessandro Volta qu’on obtient une pile électrique en plongeant deux métaux différents dans un liquide, une solution ionique. Des réactions chimiques ont lieu entre le liquide, appelé électrolyte, qui contient des ions et les métaux, et en même temps, un transfert thermique se fait avec l’extérieur.

Lors de la séance du 7 mai 1926 de la Société Française de Physique, le roumain Vasilesco Karpen présente une pile qu’il a conçue en décembre 1924. Elle est constituée de deux électrodes en platine et l’électrolyte est fait d’une solution saturée de soude. A la borne négative (anode), une lame de platine plonge entièrement alors qu’à la borne positive (cathode), l’électrode n’est plongée qu’à moitié. Alors qu’aucune réaction chimique n’est attendue, il observe qu’une force électromotrice (f.é.m.) d’environ 0,7 V est générée par son appareil. Il réalise une décharge de 2 heures et mesure que la quantité d’électricité débitée est de l’ordre du coulomb. Ce qui représente une intensité moyenne de l’ordre de 0,14 mA. Sa pile est alors déchargée à 99%. Mais après une vingtaine d’heures en circuit ouvert, la fem de la pile est revenue à sa valeur initiale. Il peut ainsi réutiliser sa pile sans qu’il n’observe de « fatigue » de sa pile. Les faibles quantités d’électricité débitées ne lui permettent pas de mesurer des différences de masse notables sur ses électrodes, ce qui aurait traduit la formation d’un dépôt ou une dégradation des électrodes.
Il décide de réaliser une électrolyse, c’est-à-dire de forcer le courant à circuler à travers les électrodes en utilisant un générateur extérieur, avec un courant de plusieurs milliampères pendant plusieurs heures, là encore, aucune variation de masse au niveau des électrodes, trahissant une réaction chimique. Il remplace l’anode par une lame de zinc et observe les résultats attendus pour une telle pile : oxydation du zinc et la masse de zinc dissoute, transformée en ion zinc (II) correspond à la quantité d’électricité débitée.
Il remarque que la f.é.m. de sa pile dépend de la quantité de cathode immergée, celle-ci étant maximum quand la lame touche à peine l’électrolyte. L’agitation des électrodes fait aussi baisser la f.é.m. (alors que la surface active tend à augmenter entre l’électrode et l’électrolyte, on est en droit d’attendre un résultat inverse). La solution doit être saturée pour obtenir un maximum de f.é.m.. Le même type d’observation est fait pour des électrodes en or ou en graphite. Ces résultats sont communiqués à la séance du 17 octobre 1927 de l’Académie des Sciences,
Très vite, on poursuit de rapporter les travaux du physicien roumain. Lors de la séance du 7 novembre 1927, Karpen émet l’hypothèse que l’énergie électrique ne peut provenir que du transfert thermique réalisé avec l’extérieur puisqu’aucune réaction chimique n’est observée sur les électrodes. Karpen donne le protocole expérimental :

Il tente d’étudier l’influence de l’air situé dans la partie émergée de ses électrodes :
« A titre d’exemple : Une pile formée d’électrodes en platine platiné noir et en graphite Acheson, plongeant clans une solution saturée de soude, a une f.é.m. de 0,450 volt. En extrayant l’air, la f.é.m. baisse graduellement, arrive au bout de 3 mois à 0,001 volt et se maintient à cette valeur pendant 6 mois, au bout desquels on laisse entrer l’air; la f.é.m. remonte en quelques minutes à 0,100 volt et dans les 10 jours suivants à 0,450 volt, valeur à laquelle elle se maintient. »
La communauté scientifique est pour le moins sceptique devant ces résultats qui semblent contredire le principe de Carnot. Vasilesco Karpen poursuit ses résultats et il continue de les communiquer à la vénérable institution qu’est l’Académie des Sciences. Le 23 janvier 1928, le roumain raconte qu’en augmentant la température de l’air extérieur, les piles débitent un courant plus important. Il allonge la durée de son expérience à 16h et il calcule la quantité de platine théoriquement consommée suite à ses mesures de f.é.m. et de quantité électrique débitée (11 C), mais là encore, la mesure de la valeur de la masse de l’électrode n’est pas en accord avec la théorie, l’électrode en platine n’ayant rien perdu. Il réfléchit si une réaction peut avoir lieu à l’électrode positive, qu’il constitue de graphite. Si une oxydation du graphite est possible, cela rendrait cette électrode négative, or ce n’est pas ce qui est observé. Le mystère reste entier.
Une autre expérience intéressante est réalisée à partir des concentrations. La solution doit être saturée, or si la concentration est plus faible, Karpen remarque que la polarité de sa pile s’inverse ! Le graphique devient l’anode, la borne négative, et le platine devient la cathode. Pour un électrolyte constitué d’eau distillée, il remarque une f.é.m. de 0,1 V. Dans la solution saturée, la présence d’oxygène dans l’air semblait indispensable pour qu’une f.é.m. existe, ce qui tendait à penser qu’une réaction avait lieu entre l’électrode et l’air.
Avec un dispositif ingénieux, Karpen s’applique à mesure la f.é.m. à différentes températures. La pile se trouve dans le tube A. Le tube A communique avec le tube B avec une pompe à vide et un manomètre. Le vide est maintenu pendant une vingtaine d’heures, chauffant alternativement les tubes A et B à environ 95°C et en faisant passer l’eau par évaporation, plusieurs fois de A dans B ; le tube A vidé d’eau est également chauffé, dans le vide, de façon à purger pratiquement d’air le système. La pince p est alors serrée et A est placé dans un thermostat.
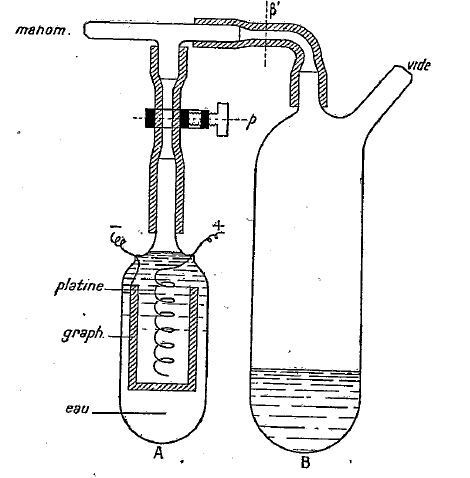
Ses résultats montrent que sans air, la f.é.m. augmente avec la température.
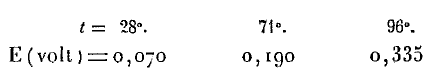
Il semble que le dispositif absorbe la chaleur du milieu extérieur et que la f.é.m. double pratiquement lorsque la température augmente en faible proportion dans une gamme élevée. Karpen est dans l’expectative.
En parallèle, Karpen poursuit ses recherches en thermodynamique, apportant des contributions remarquables, comme une démonstration de la formule de Clapeyron à partir de l’équation de Van der Waals, ou encore de celle de Maxwell-Clausius. Il s’intéresse aux problèmes de saturation rencontrés sur les électrodes.
En 1944, Karpen reprend ses publications. Lors de ses précédentes expériences, malgré son dispositif, il restait une fraction d’air. Cette fois, dans une pile constituée de platine platiné à la cathode et de platine poli à l’anode, il met en évidence que si l’air est complètement absent, la f.é.m. s’annule. Il conclue que nécessairement, sa pile est une pile de concentration à oxygène. Le platine platiné, plongé dans l’eau (acidulée ou non), contenant en solution l’oxygène de l’air, se couvre d’une mince couche où la concentration de l’oxygène est de beaucoup supérieure à celle du reste du liquide, où se trouve plongée l’électrode en platine poli.
Voilà comment Karpen explique le phénomène :
« A l’intérieur de la pile, les ions, provenant de la dissociation de deux molécules d’eau; se dirigent, les H+ vers le platine platiné, les HO– vers le platine poli. A l’électrode positive les deux électrons e– sortant du métal, ionisent un des atomes d’oxygène dissous dans l’eau; l’ion O2- ainsi formé rencontrant les 2H+ produit une molécule d’eau. A l’électrode négative deux ions HO– perdent leurs électrons (qui passent dans le métal) et donnent un atome d’oxygène et une molécule d’eau. Donc les deux molécules d’eau dissociées sont reconstituées et l’atome d’oxygène perdu à l’électrode positive est regagné à l’électrode négative. Il n’y a pas d’électrolyse, l’oxygène s’accumule à l’électrode négative dont le potentiel augmente et repasse par diffusion à l’électrode positive; pendant le repos de la pile la diffusion continue, ramenant le tout à l’état primitif. »
Lors de la séance du 21 février 1944, il détaille :
« D’autre part cette pile, empruntant- indéfiniment son énergie uniquement au milieu ambiant, contredit formellement le second principe de la thermodynamique.Il convient donc de montrer quel est le phénomène élémentaire auquel est due cette contradiction, et qui produit la différence de potentiel ci-dessus mentionnée. »
Sûr de sa chimie et des processus à l’œuvre dans sa pile, Karpen explique les mouvements des différentes entités, ions et électrons, dans sa pile. Le phénomène de diffusion est au cœur de son raisonnement. Il finit par conclure :
« On se refuse généralement à admettre l’existence d’un phénomène (à notre échelle) contraire au second principe. Cette répulsion ne me semble pas justifiée. Le second principe est devenu un théorème de mécanique statistique (valable dans un domaine sans doute très étendu, mais limité), et il ne semble nullement interdit de douter de son infaillibilité, en dehors de ce domaine. »
Karpen nous indique donc qu’avec sa pile, il a touché un phénomène qui remet en question un des principes fondamentaux de la physique. Rien que ça.
En 1946, Karpen, grand spécialiste de l’électrochimie introduit un phénomène : la sous-tension. Si la surtension est un phénomène connu lors des réactions électrochimiques, Karpen introduit un phénomène opposé mais totalement inexpliqué pour expliquer les f.é.m. rencontrées dans ses expériences. Il conclue en disant que les limitations techniques empêchent pour le moment d’explorer ce phénomène. Soit.
En 1948, Karpen remplace l’air ambiant par de l’hydrogène et observe un comportement similaire dans sa pile, même si les performances sont moins bonnes. La même année, Karpen reprend l’étude thermodynamique en s’appuyant sur l’équation de Nernst et les principes fondamentaux de la thermodynamique. Mais rien n’y fait, les résultats expérimentaux sont bien différents de ce que propose la théorie.
« L’expérience contredit les formules, en montrant que la force électromotrice mesurée, d’une pile à oxygène, est environ 6,3 fois plus grande que celle donnée par ces formules. »
Dans ses calculs, Karpen assimile concentration et activité et ne croit pas qu’il faille corriger les activités dans les électrolytes forts comme le suggère le chimiste américain Gilbert Lewis. Or la force ionique et la fugacité, sont, on le sait aujourd’hui, des éléments à prendre en compte en chimie des solutions.
Plus aucune trace de publications dans les Compte Rendus de l’Académie des Sciences, pour ce que j’ai pu en tirer. En 1949, il avait déjà 79 ans. Vasilesco Karpen meurt en 1964 à l’âge de 94 ans.
Références bibliographiques et webographiques
Karpen V., Sur des piles à électrodes identiques inaltérables, Comptes Rendus de l’Académie des Sciences, tome 185, p.766, Séance du 17 octobre 1927.
https://gallica.bnf.fr/ark:/12148/bpt6k31384/f766.item
Karpen V., Sur des piles à électrodes inattaquables, Comptes Rendus de l’Académie des Sciences, tome 185, p.942, Séance du 7 novembre 1927.
https://gallica.bnf.fr/ark:/12148/bpt6k31384/f942.item
Karpen V., Les piles à électrodes inaltérables et le principe de Carnot, Comptes Rendus de l’Académie des Sciences, tome 186, p.230, Séance du 2 janvier 1928.
https://gallica.bnf.fr/ark:/12148/bpt6k3139f/f230.item
Karpen V., Nouvelles recherches sur les piles contredisant le second principe de la thermodynamique, Comptes Rendus de l’Académie des Sciences, tome 187, p.418, Séance du 20 août 1928.
https://gallica.bnf.fr/ark:/12148/bpt6k3140x/f418.item
Karpen V., L’équation de Van der Waals et les principes de la thermodynamique ; la relation de Maxwell-Clausius et la formule de Clapeyron déduites de cette équation, Comptes Rendus de l’Académie des Sciences, tome 187, p.1039, Séance du 3 décembre 1928.
https://gallica.bnf.fr/ark:/12148/bpt6k3140x/f1039.item
Karpen V., Sur des piles électriques empruntant leur énergie indéfiniment au milieu ambiant, Comptes Rendus de l’Académie des Sciences, tome 218, p.228, Séance du 07 février 1944.
https://gallica.bnf.fr/ark:/12148/bpt6k3170r/f228.item
Karpen V., La diffusion au contact de deux milieux non miscibles et le second principe de la thermodynamique, Comptes Rendus de l’Académie des Sciences, tome 218, p.310, Séance du 21 février 1944.
https://gallica.bnf.fr/ark:/12148/bpt6k3170r/f310.item
Karpen V., La surtension et la sous tension en électrolyse, Comptes Rendus de l’Académie des Sciences, tome 222, p.644, Séance du 18 mars 1946.
https://gallica.bnf.fr/ark:/12148/bpt6k31740/f644.item
Karpen V., Piles à hydrogène empruntant leur énergie indéfiniment au milieu ambiant, Comptes Rendus de l’Académie des Sciences, tome 226, p.1273, Séance du 19 avril 1948.
https://gallica.bnf.fr/ark:/12148/bpt6k31787/f1273.item
Karpen V., La force électromotrice de la pile de concentration à oxygène et la thermodynamique, Comptes Rendus de l’Académie des Sciences, tome 227, p.767, Séance du 18 octobre 1948.
https://gallica.bnf.fr/ark:/12148/bpt6k3179j/f759.item
Karpen V., La variation de la force électromotrice de la pile à gaz avec la pression. Force électromotrice de la pile de concentration à oxygène, Comptes Rendus de l’Académie des Sciences, tome 228, p.231, Séance du 17 janvier 1949.
https://gallica.bnf.fr/ark:/12148/bpt6k31801/f231.item
Wikipedia, Niculae-Vasilescu Karpen.
https://fr.wikipedia.org/wiki/Nicolae_Vasilescu-Karpen
World Record Academy, Longest running wet cell battery : Karpen’s Pile, 11 octobre 2018https://www.worldrecordacademy.org/records/technology/longest-running-wet-cell-battery-karpen-s-pile-218245
Laisser un commentaire